Las Disoluciones son una mezcla homogénea donde sus elementos o componentes no se observan a simple vista, por ese motivo el perfil molecular o iónico de dos o más elementos no reaccionan entre sí, esto quiere decir que siguen siendo los mismos luego de ser mezclados, además por ser una mezcla homogénea no se logran diferencian sus elementos. Un ejemplo usual suele ser un sólido diluido en un líquido, como la azúcar o la sal disueltas en agua. Disoluciones (Características, concepto y componentes)
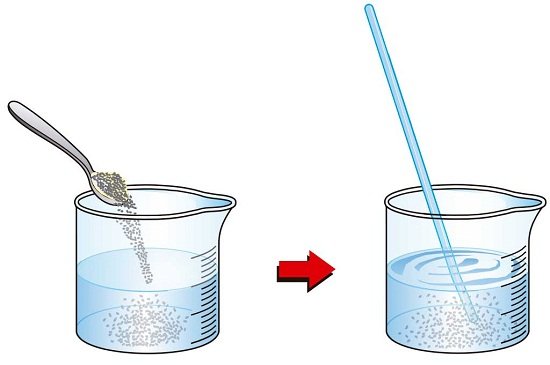
Componentes de una disolución
El componente más excesivo en las Disoluciones se le conoce como disolvente y el resto de los elementos se le conoce como Soluto. Pero las Disoluciones igualmente son conocidas como solución o disolución y el disolvente se le denomina como solvente. Como hemos dicho, usualmente el disolvente siempre será líquido por lo tanto la disolución permanecerá en ese estado de la materia. Por ejemplo en el caso del agua con sal, el agua viene siendo el disolvente y la sal será el soluto.
Solubilidad
En una solución, la máxima cantidad de soluto propuesta en gramos se logra disolver por cada 100 gramos de un disolvente. Debemos tomar en cuenta que entre más caliente se encuentre el líquido más cantidad de soluto resistirá. Lo líquidos y los sólidos se diluyen mejor cuando el líquido esta a una alta temperatura. Por ese motivo el soluto es más soluble en este nivel de temperatura.
Por ejemplo en un recipiente con agua a 20ºC esta tiene la capacidad de absorber 10 gramos de sal, pero cuando esta a 50ºC tiene la capacidad de disolver hasta más de 100 gramos de sal. Por lo tanto la solubilidad incrementa con la temperatura de la solución.
Concentración
Se considera como la cantidad de soluto que se encuentra disuelto en una cierta cantidad de solución. Pero la cantidad de soluto y la cantidad de la solución, nos proporciona una relación sobre la cantidad de soluto que se encuentra en la solución.
Es importante conocer que las cantidades de soluto se logran pronunciar en gramo, volumen, moles, entre otros términos químicos dependiendo del peso manejado. Por ejemplo un alcohol de uso domestico está compuesto con 70% de alcohol puro y el resto de la mezcla es agua representando el 30%.
Características de Disoluciones
Son liquidas
En la composición homogénea de uno de los dos elementos es líquido, habitualmente agua, esta composición homogénea es lo que se suele conocer como una disolución. Las Disoluciones químicas suelen ser de estado líquido.
Son mezclas homogéneas
Las disoluciones se consideran como mezclas homogéneas, donde las proporciones referentes de solutos y solvente se conservan en cualquier cantidad que usemos de la disolución. Además no se logran separar por el método de centrifugación ni filtración.
No se descompone fácilmente
La disolución química de los elementos de una solución no se descompone fácilmente. Sus elementos se distancian o se dividen solo por cambios de fases especiales como la evaporación, condensación, fusión entre otros procesos de destilación química.
Conserva la separación de sedimentación
Cuando una solución es sometida a una técnica de centrifugación los átomos del soluto no se depositan debido a que el mol de las mismas es inferior a 10 Angstrom.Donde Angstrom es una unidad de distancia utilizada fundamentalmente para expresar las longitudes de onda, los recorridos atómicos y nucleares.
Disoluciones empíricas o disoluciones cualitativas
Esta tipificación no toma en cuenta la cantidad numeral de soluto y disolvente, por lo tanto las Disoluciones cualitativas siempre dependerá de la simetría entre ellos, por ese motivo se catalogan de la siguiente forma:
Disolución diluida: Es cuando la cantidad de soluto que se interpone se encuentra en mínima simetría en un volumen establecido.
Disolución insaturada: Es cuando no posee la cantidad máxima adecuada de soluto para una temperatura y presión proporcionadas.
Disolución saturada: Poseen la mayor cantidad de soluto adecuado para una temperatura y presión proporcionadas. En ellas se mantienen un equilibrio entre el soluto y el solvente.
Disolución sobresaturada: Domina más soluto del que suele existir en proporción a una temperatura y presión dadas.
Disoluciones Isotónicas
En las soluciones isotónicas o ligeramente hipotónicas, se logra deducir que es una concentración excesiva de solutos que dificultará la absorción del agua. Para evitar que esto suceda, los hidratos de carbono no deben predominar en el 10% de la solución
Por lo tanto son mezclas con gran capacidad de rehidratación, incluyendo en su estructura habitual bajas dosis de sodio, usualmente en forma de cloruro de sodio, potasio, glucosa, bicarbonato sódico, azúcar y otros minerales.
Disoluciones Hipotónicas
Una solución Hipotónico es el total de la concentración molar de todos los átomosdisueltos, es menos que el de otra disolución. Cuando las concentraciones de solutos son disueltos fuera de la célula que dentro de ellas, la concentración de agua en la zona externa es extensa.
Disoluciones Hipertónicas
En una disolución hipertónica, la agrupación molar total de todos los átomos del soluto disuelto, es más extenso que el de la otra disolución o más extensa que la concentración de célula.
Estado de agregación de las disoluciones
Coloidal
Son Disoluciones que reaccionan con dos elementos, de dos estados completamente diferentes. En la vida diaria la podemos apreciar en la composición de la mayonesa.
Sólido en Sólido. En este término el soluto y el solvente se conservan en un estado sólido. Un ejemplo particular de este tipo de Disoluciones son las fusiones del Zinc en el Estaño.
Gas en Sólido: Un ejemplo particular es el hidrógeno, el cual se disuelve en los metales, principalmente en el paladio.
Líquido en Sólido: Es cuando una sustancia líquida se diluye junto con un sólido.
Sólidos en Líquidos: Este tipo de soluciones son las más usadas, ya que se diluyen en pequeñas cantidades de sustancias sólidas.
Gases en Líquidos: el ejemplo más particular de este tipo es el oxígeno en agua.
Líquidos en Líquidos: Es otra de las soluciones más usadas. El ejemplo más usual es la mezcla de Alcohol en Agua.